Что происходит, когда вы удаляете нейтрон из атома?
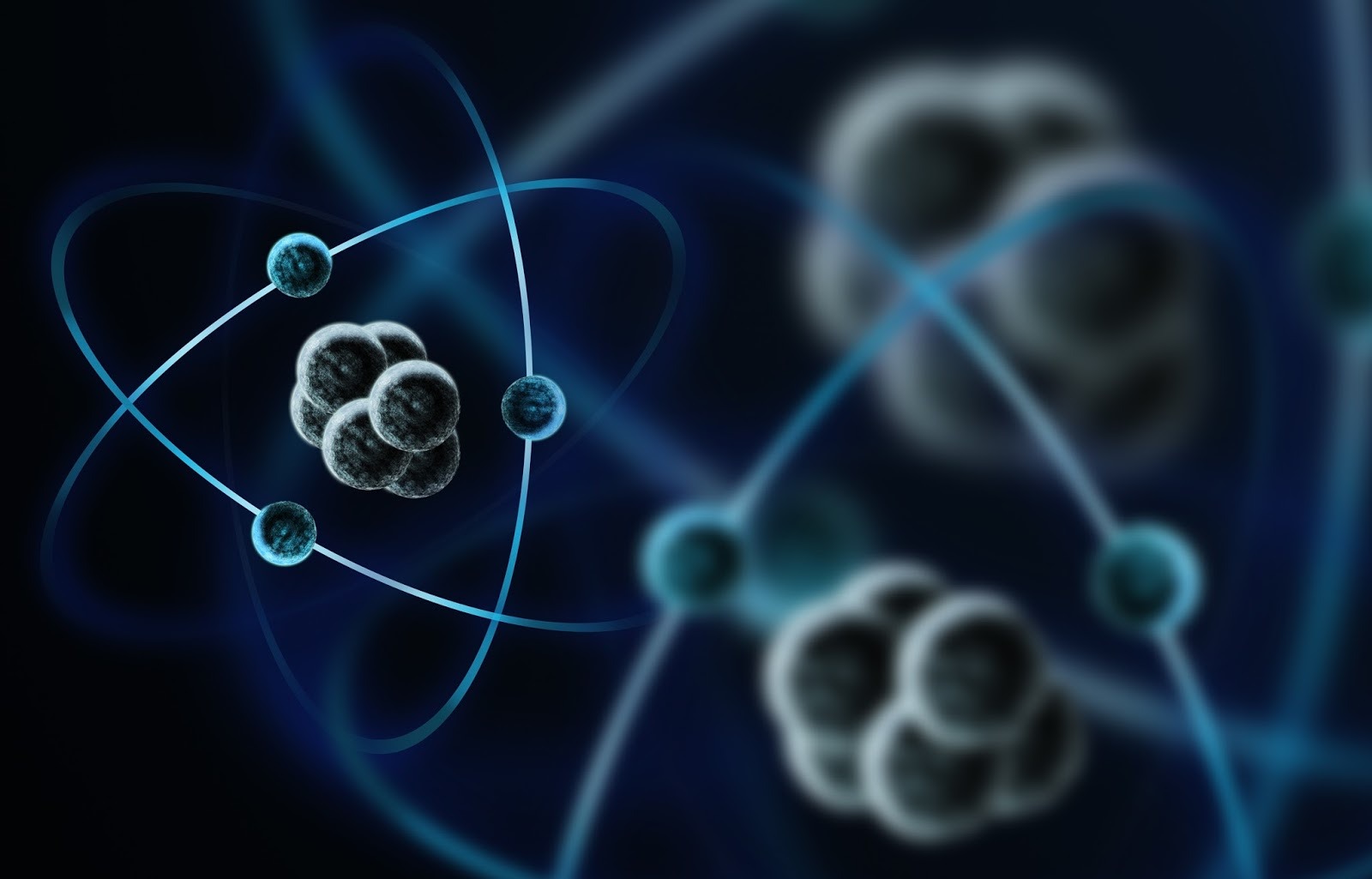
Когда вы удаляете или добавляете нейтрон к ядру атома, получаемое вещество представляет собой новый тип того же элемента и называется изотопом.
Все, что вы видите вокруг, состоит из материи, а вся материя состоит из атомов. Могут ли атомы разрушаться дальше? Определенно да. Атомы состоят из протонов, нейтронов, электронов и группы различных субатомных частиц, о которых большинство из нас не знает.
Теперь, если все состоит из атомов, а сами атомы состоят из субатомных частиц, приведет ли изменение в комбинации субатомных частиц к новому, другому виду материи? Это, безусловно, так.
Если бы вы удалили электрон из атома, у вас остался бы положительно заряженный ион, готовый связываться с другим противоположно заряженным ионом. Если протон вынимается или добавляется к атому, образуется целый новый элемент (вам также необходимо добавить или удалить такое же количество нейтронов, чтобы сохранить стабильность ядра). Однако что происходит, когда вы удаляете нейтрально заряженный нейтрон из атомного ядра? Возможно, новый элемент?
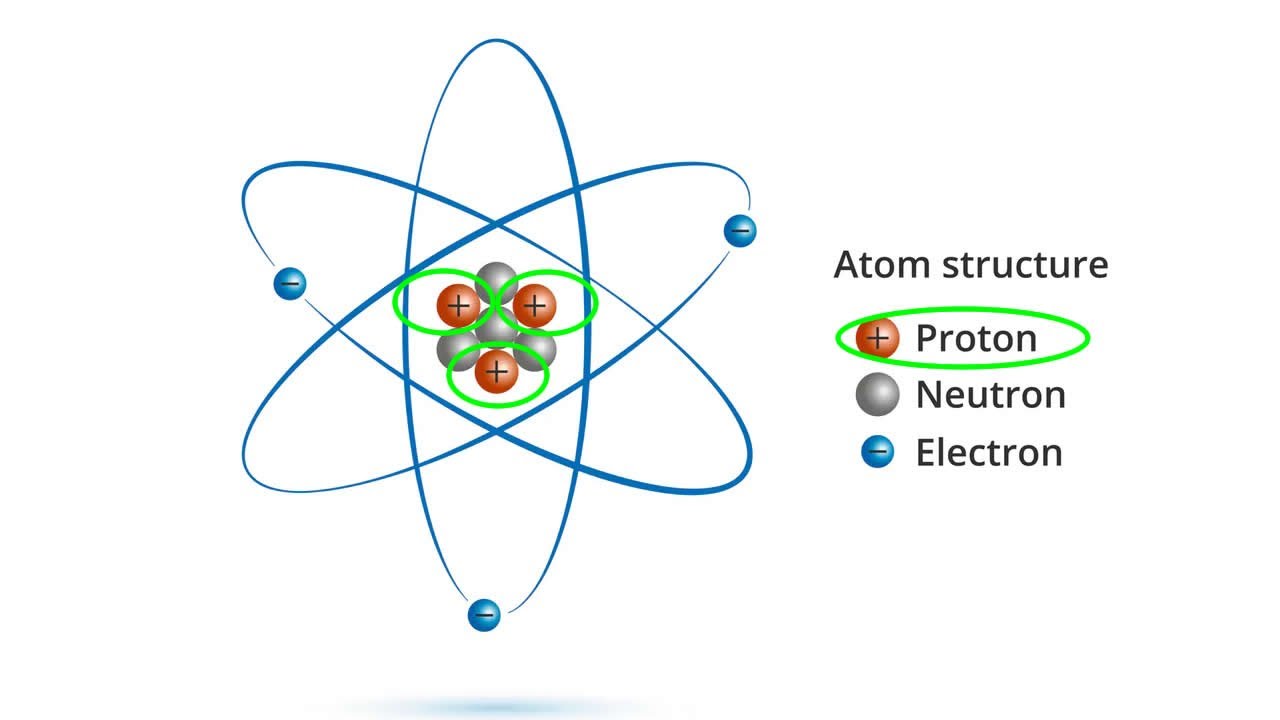
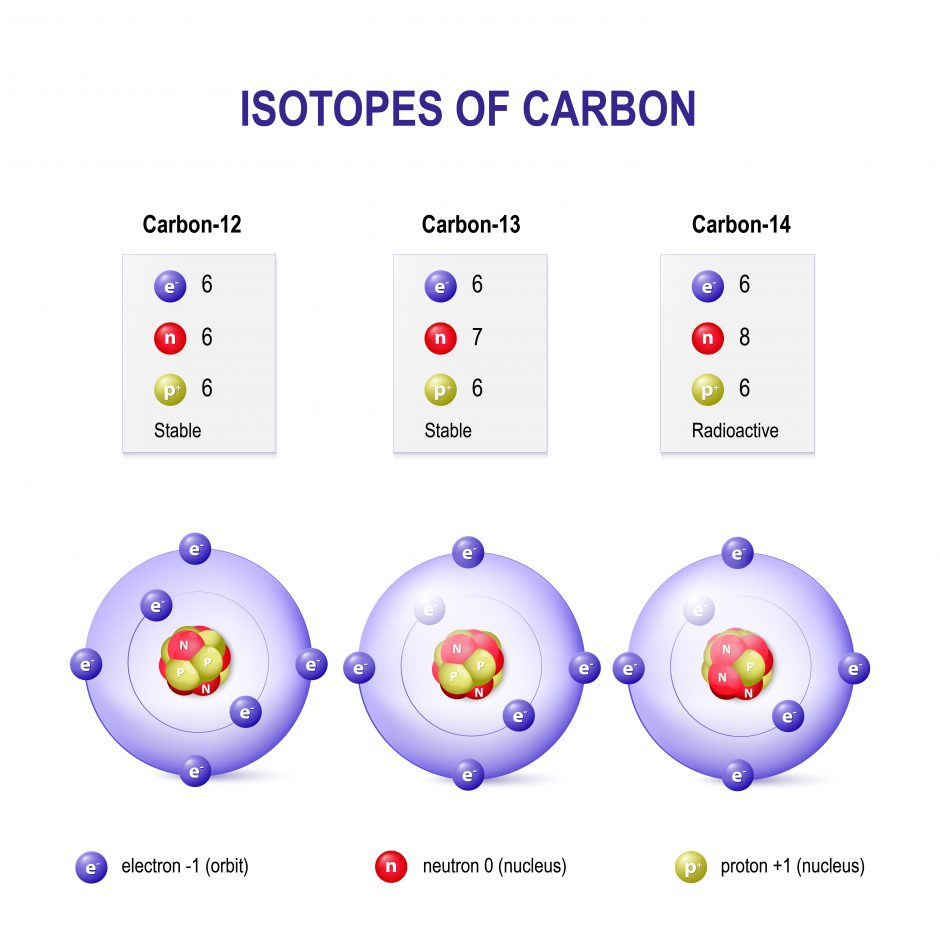
Изотопы
Когда вы удаляете или добавляете нейтрон в ядро атома, вы технически не получаете новый элемент, но у вас есть новый тип того же элемента в вашей руке. Этот новый тип называется «изотоп» элемента. Изотопы формально определяются как элементы с одинаковым количеством протонов, но с разным количеством нейтронов в ядре. Другое определение изотопов определяет их как атомы с одинаковым атомным номером (числом протонов), но разными атомными массовыми числами (сумма нейтронов и протонов атома). Изотопы элемента также имеют такое же количество электронов.
Хорошо, давайте использовать недавно выпущенные iPhone, чтобы понять концепцию изотопов в более доступной форме. Apple недавно выпустила три новых устройства в серии Apple iPhone, а именно: iPhone 11, iPhone 11 Pro и iPhone 11 Pro Max. Pro и Pro Max – это не что иное, как другой вариант или тип iPhone 11. Оба могут быть идентифицированы как тип iPhone 11, потому что они используют один и тот же чип A13 Bionic, или просто потому, что они были выпущены в 2019 году.
Все элементы идентифицируются исключительно на основании их атомного номера, то есть количества протонов в ядре. Таким образом, аналогично айфонам элементы с одинаковым количеством протонов (айфоны с чипом A13), но с разным количеством нейтронов (разное количество камер или размер батареи) идентифицируются как разные типы одного и того же элемента, а не совершенно новый элемент.
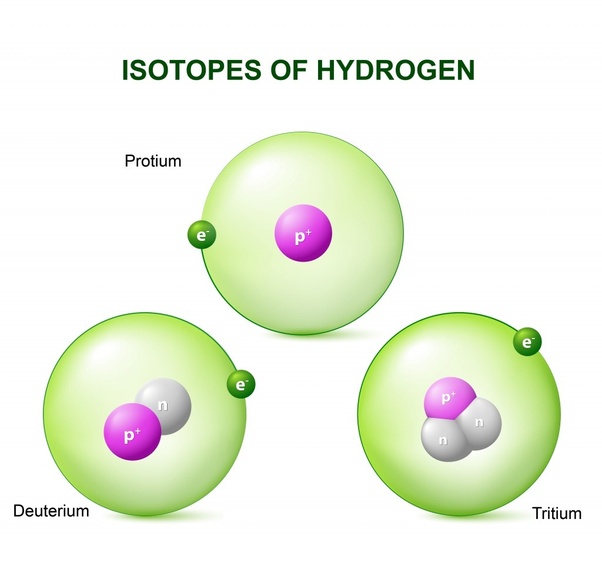
История изотопов
Существование радиоактивных изотопов было впервые обнаружено радиохимиком Фредериком Содди в 1913 году при изучении радиоактивных каскадов (серии радиоактивных распадов). Содди обнаружил 40 различных видов элементов (называемых радиоэлементами) между ураном и свинцом. Тем не менее, периодическая таблица допускает только 11 элементов между двумя. Пытаясь поместить эти 40 элементов в периодическую таблицу, Фридрих Содди и Казимеж Фаджанс разработали теорию радиоактивного смещения.
Теория предполагала, что альфа-распад (радиоактивный распад, при котором атом испускает ядро гелия, т.е. 2 протона и 2 нейтрона) производит элемент в двух местах слева от родительского элемента в периодической таблице, тогда как бета-распад (испускание электрон или позитрон) приводит к появлению элемента в одном месте справа от родителя.
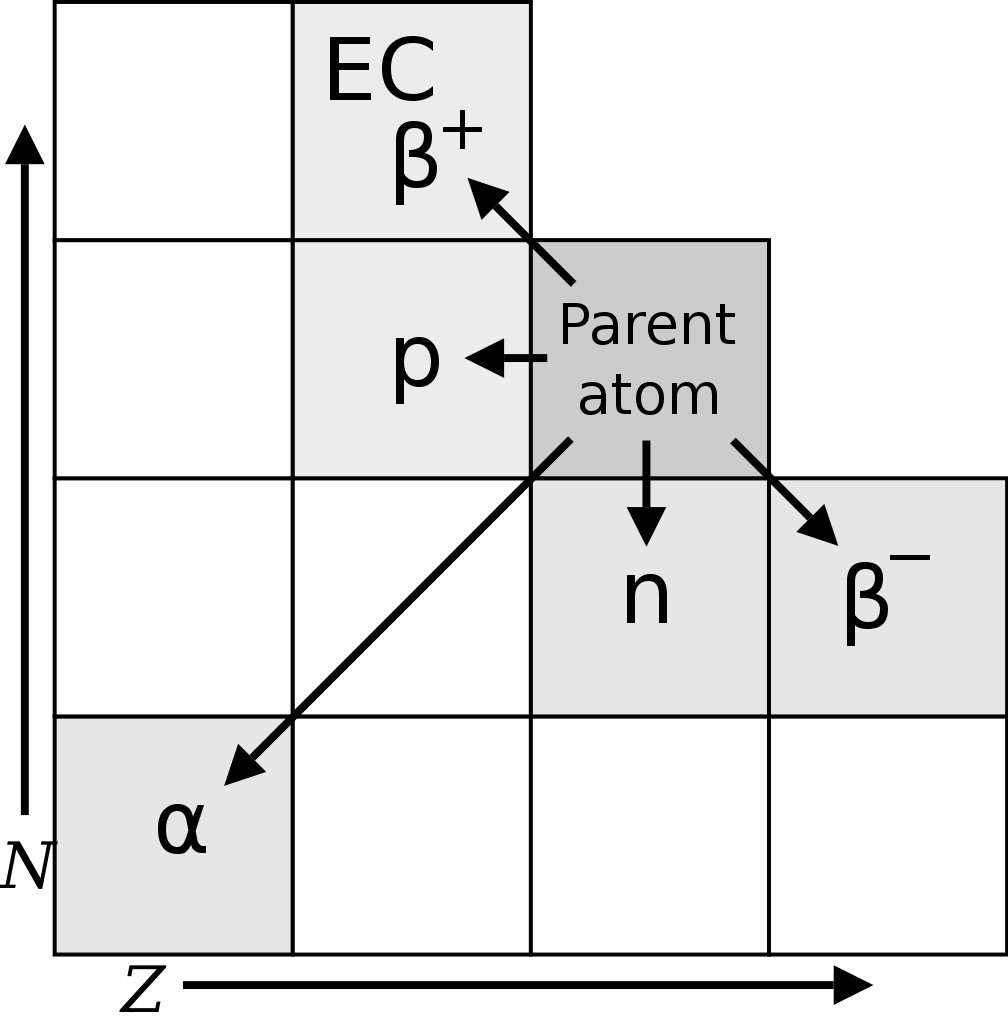
Однако Содди заметил, что некоторые радиоэлементы имели разные атомные веса / массы, но сохранили химические свойства своего родительского элемента и поэтому должны занимать то же место в периодической таблице. Маргарет Тодд, друг Фредерика Содди, ввела термин «изотопы» для этих радиоэлементов. Слово изотоп по-гречески означает «в том же месте». Содди был удостоен Нобелевской премии по химии в 1921 году за его вклад в понимание радиоактивных элементов и исследования и открытия изотопов. Дж. Дж. Томсон нашел первые стабильные изотопы элемента в 1913 году.
Разница в свойствах между изотопами
Для простоты мы можем разделить свойства элемента на две части – химические свойства и физические свойства. Химические свойства – это способность и склонность элемента и, следовательно, его атомов к химическим реакциям с образованием соединений или других элементов. Эти свойства определяются количеством электронов, присутствующих в атоме. Поскольку изотопы элемента имеют различное количество нейтронов, но одинаковое количество электронов, они имеют сходные химические свойства. Однако изотопы водорода являются исключением.
С другой стороны, физические свойства, такие как температура кипения и температура плавления элемента, зависят от его атомного массового числа. Разница в массовом числе придает изотопу различные физические свойства от его родителя. Однако ядерные свойства изотопов отличаются друг от друга и также составляют основу их классификации.
Изотопы классифицируются на основании их стабильности или склонности к распаду. Из 339 встречающихся в природе изотопов около 252 считаются стабильными. Тем не менее, только 146 из них на самом деле стабильны, а остальные 106 теоретически подвержены распаду. Поскольку до сих пор таких наблюдений не было сделано, мы считаем их наблюдательно устойчивыми.
Кроме того, из 339 естественных изотопов 286 являются исконными, то есть они существовали с момента образования Солнечной системы. Общее количество подтвержденных на сегодняшний день изотопов, а также искусственно созданных, превышает 3300. Более 2400 из них имеют период полураспада менее 60 минут. Каждый элемент имеет один или несколько радиоактивных изотопов, в то время как элементы с атомными номерами больше 83 имеют только радиоактивные изотопы.
Заключение
Это может быть захватывающим предметом, но удаление нейтронов из ядра атома – это не прогулка в парке. Изотопы в первую очередь обнаруживаются на использованных стержнях ядерных реакторов в качестве побочных продуктов ядерных реакций. Они искусственно создаются путем бомбардировки стабильных атомов альфа-частицами (ядром гелия) в ускорителе частиц. Другие методы включают облучение исходных изотопов нейтронами в ядерном реакторе или использование циклотрона.
Радиоактивные изотопы находят применение во многих областях. Наиболее перспективной является дисциплина ядерной медицины и лечения рака. Промышленное использование включает в себя внутреннюю безопасность, облучение пищевых продуктов, промышленную радиографию, геологию, астрономию и т. д. По мере того, как мы продолжаем открывать новые изотопы в будущем, кто знает, какие новые виды применения мы найдем!